Ácido cítrico en zumos
Objetivo: Determinar el ácido cítrico en zumo de naranja recién preparado y en zumo comercial (también se puede realizar con zumo de limón).

-
Material de laboratorio
Erlenmeyer
Vasos
Bureta
Exprimidor de fruta
-
Reactivos
Naranjas
Limones
Zumo de naranja/limón comercial
Fenolftaleína
Hidróxido sódico 0,5 M (NaOH)
Agua
-
Seguridad
¡¡¡No olvides los guantes, la bata de laboratorio y las gafas protectoras!!!
-
Preguntas
¿Qué reacción tiene lugar durante la valoración?
Determina la concentración de ácido cítrico en todos los zumos. ¿A qué conclusiones se puede llegar?
Procedimiento
- Exprime la naranja y el limón y guarda los zumos en dos vasos de precipitados.
- Añade 10 mL de zumo de naranja en un matraz Erlenmeyer y, a continuación, añade 25 mL de agua y unas gotas de fenolftaleína.
- Valorar esta solución con hidróxido sódico 0,5 M.
- Repite el proceso con 10 ml de zumo de limón recién preparado.
- Por último, repite el proceso con los zumos comerciales y compara los resultados.
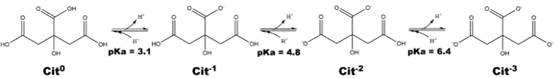
Explicación teórica
Es bien sabido que los zumos de naranja y limón son ácidos. El principal compuesto químico responsable de esta acidez es el ácido cítrico, un ácido carboxílico triácido que se produce mediante la fermentación de azúcares (>106 toneladas al año) para su uso en bebidas y alimentos (70%), detergentes (20%) y cosméticos, productos farmacéuticos y otras aplicaciones (10%).
En contacto con el agua, la desprotonación de los tres ácidos carboxílicos da lugar a tres equilibrios ácido/base, cada uno con su constante de acidez (Ka):
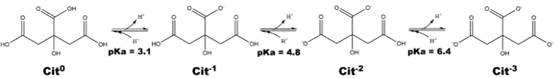
Al valorar el ácido cítrico con NaOH, el pH de la solución se vuelve más básico y los ácidos se desprotonan. Una vez que hemos añadido la base suficiente para desprotonar todos los ácidos (formando Cit3- en el diagrama), la siguiente gota de NaOH hace que el pH de la solución valorada aumente bruscamente de 7 a más de 9. Este cambio de pH hace que la fenolftaleína se vuelva rosa, ya que su pH final se sitúa en torno a 8-8,5. En este punto, la valoración se considera completa.
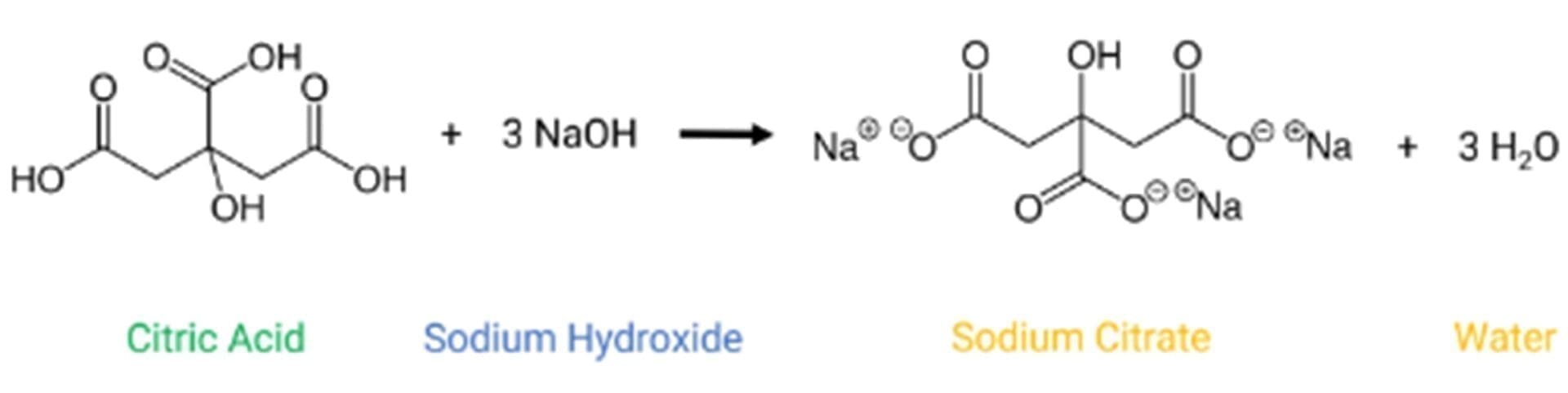
Como conocemos el volumen de NaOH 0,5 M que hemos utilizado, podemos calcular los moles de base necesarios para neutralizar el ácido cítrico presente en el zumo. Sabiendo que la relación estequiométrica entre el triácido y la base es 1:3, podemos calcular los moles de ácido cítrico presentes en la muestra. Por último, podemos utilizar el peso molecular del ácido cítrico (192,124 g/mol) para calcular la masa.
La reacción química es:

Creemos un futuro más brillante
Únete a nuestro equipo para trabajar con investigadores de renombre, emprender proyectos innovadores y contribuir a avances científicos significativos.
Únete a nosotros!













